氘与氧组成的水。是氘的最重要的化合物,化学式为D2O。1931年底,H.C.尤里等发现氘后,又发现电解槽废液中氘的浓度增加,提出用电解水法浓缩重水的设想。1933年G.N.路易斯和R.T.麦克唐南将10升电解槽废液经反复电解后,得到0.5微升重水,浓度约为65.7%,再电解而得到近乎纯的重水。用这最初的微滴重水,测定了重水的某些物理常数。1935年挪威利用廉价的水电能建立了世界第一座重水工厂,生产重水供研究用。40年代以来,由于核裂变的发现,重水成为反应堆的重要材料,开始以工业规模大量生产。
重水的分子量为 20.0275,比普通水的分子量18.0153高出约11%,由于其质量差别不像氘与氢之间那么大,在物理、化学性质上的差别也小些。而且因为水是一个多原子的极性分子,分子之间除了范德瓦耳斯力外,还有很强的氢键力存在;重水分子比轻水分子有较强的氢键力和范德瓦耳斯力,前者的作用比后者更为显著,因此,重水有较高的熔点和沸点,较小的蒸气压,较大的熔解热、蒸发热和升华热。其性质之间的差异不像氘、氢之间那样规律。重水和普通水的性质比较见表1。
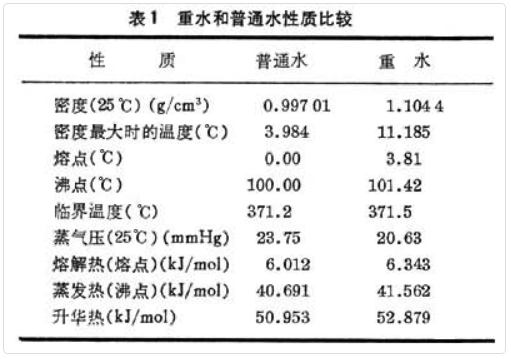
重水之得名就是由于它的密度比普通水要大不少,常用的重水含量测定法就是基于重水样品的密度或比重。重水和普通水在 0°C到临界温度之间的密度已被精确测定,它们在40°C时具有最大的密度差值,在370°C时密度相等。轻、重水之间蒸气压的差别是水精馏法富集重水的理论基础。在通常温度下,重水的蒸气压较普通水小;随着温度的上升,普通水与重水的蒸气压差值逐渐增大,直至170°C达到最大值(83毫米汞柱),然后又减小,到225°C时重水和普通水的蒸气压相等;而在225°C以上时,重水的蒸气压反而比普通水为大。
粘度是重水与普通水的物理常数中相差最大的一个。25°C时,重水的粘度要比普通水大2.3%。重水的表面张力略低于普通水,在25°C时二者的比值为0.99946。重水的折射率比普通水稍小,20°C时对波长5893埃的光的折射率差值为0.00470,利用折射率差异的干涉仪法也是重水的分析方法之一。重水的介电常数低于普通水,25°C的比值为0.9963。盐类在重水中的溶解度比在普通水中低些,25°C时,1克普通水能溶解 0.3592克氯化钠,但1克重水只能溶解 0.3056克。碘在四氯化碳与普通水之间的分配系数是85:1,而在四氯化碳与重水间的分配系数是103:1。
许多电解质在重水中的电导率要比在普通水中小得多,这是因为电解质在溶液中的电导率及它们的离子活动性与介质的粘度成反比。液体重水的离解度比普通水约小4/5,重水是比普通水更弱的电解质,因此酸(或碱)在重水中的强度比在普通水中要小一些。
重水与含氢化合物中─OH或─NH基团上的 H立刻发生交换,与─CH键上的H一般不发生交换。重水和空气中的普通水蒸气(潮气)发生交换,当重水暴露于潮湿空气中时,浓度会逐渐降低,因此操作重水时应注意尽量不和空气接触。
所有重氢化合物的零点能比相应的轻氢化合物小,即有较高的活化能,因此反应速率就较小。例如,20°C时分别以重水或普通水作为溶剂,则H2O2+I-─→H2O+IO-反应的速率常数比值(kD/kH)为0.60。
重水对生物有不利的影响。重水对一般动物的致死浓度约为60%,单细胞生物对重水的适应能力较强。
核电站除了要用铀作核燃料外,还需要上百吨的重水作慢化剂和冷却剂;氘是核聚变反应的核燃料,重水是重要的氘源;此外,由于在80%以上的有机物中,氢是重要成分之一,氘作为氢原子的同位素示踪原子,已广泛应用于各个领域的研究。因此,重水的大规模生产成为核工业的重要部分。
1935~1943年,世界上只有挪威一家重水工厂,用电解法年产1.5~2吨重水。1943年美国建立一个H2/H2O交换工厂和三个水精馏工厂生产重水,年产量约21吨。50年代初,美国开发了H2S/H2O双温交换(GS过程)法生产重水,并建成两个大厂,年产量增至300吨。与此同时,苏联和西欧开发了液氢精馏法、H2/NH3交换法等,并建成工厂。60年代世界重水年产量约510吨,70年代世界重水年生产总能力达1850吨。中国自50年代起,开发重水生产,80年代开始出口重水。
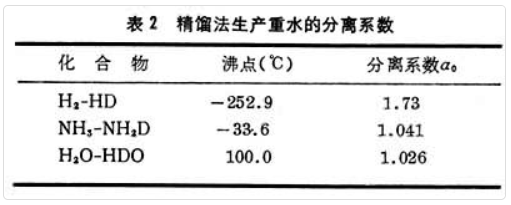
氘的天然丰度为0.015%,反应堆所需的重水纯度要求在 99.75%以上。重水生产的特点是分离级数多、平衡时间长、处理物料量大、能耗大。由天然浓度浓缩到约1%的方法选择十分重要,重水生产的成本主要取决于初浓段的成本。重水生产的主要方法有下列三种。
精馏法
利用氘化合物的蒸气压特点而浓缩。主要原料为氢、氨、水等。蒸馏时的分离系数α0见表2。液氢精馏的分离系数大,但低温技术和设备限制了生产规模;目前最大的液氢精馏重水厂年产14吨重水。水精馏操作简单可靠、原料充足,但因分离系数小而能耗过大;1943年美国建成三个厂,开工两年后关闭。氨精馏分离系数略大于水,潜热小,但受氨源限制,用作初浓方法不经济。
电解法
电解水时,氘的电解分离系数可达10左右。一般用碱性电解液、低碳钢阴极,可使重水较快浓缩。此法在40年代以前是生产重水的唯一方法,现因能耗太大,已不单独使用。
化学交换法
目前生产重水最经济的方法。常用的交换反应有:
反应的分离系数见表3。化学交换法的实际操作过程分为单温交换法和双温交换法。
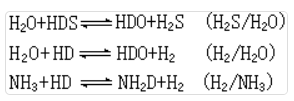
1943年在加拿大建成第一座 H2/H2O交换法重水厂。用催化剂 (Pt─C或Ni-Cr2O3)使氢与水蒸气进行同位素交换,用电解法使水转变为氢。年产重水 6吨。H2/H2O交换反应的分离系数大,但需要用催化剂。
H2/NH3交换工厂一般附在大合成氨厂中, 用溶在液氨中的 KNH2作催化剂,使氢气与液氨进行同位素交换。KNH2遇水易爆炸是此法的极大缺点。
H2S/H2O交换法是比较成功的生产方法。反应不需催化剂,采用双温过程,用H2S循环,以水为进料,生产规模不受限制。50年代初建立的工厂的重水年产量已达 540吨。80年代中期,加拿大已投产工厂的设计生产能力达每年1600吨。
新开发的有吸氢合金吸附分离、激光分离等方法(见同位素分离)。
重水的应用
重氢的热中子吸收截面仅为5.3×10-4靶恩,比氢(0.332靶恩)小得多,所以重水的主要用途是在反应堆中作慢化剂和冷却剂。重水分解产生的氘还是重要的热核燃料。在化学和生物学中,重水还用作示踪物,进行反应机理和有关方面的研究。