同位素质谱最初是伴随着核科学与核工业的发展而发展起来的,同位素质谱是同位素地质学发展的重要实验基础。当前我国同位素质谱技术已深入到矿床同位素地球化学、岩石年代学、有机稳定同位素地球化学、无机稳定同位素地球化学等各个方面,并在国家一系列重大攻关和研究课题中发挥重大作用,如金矿和石油天然气研究、水资源开发等。稳定同位素技术的出现加深了生态学家对生态系统过程的进一步了解,使生态学家可以探讨一些其它方法无法研究的问题。与其它技术相比,稳定同位素技术的优点在于使得这些生态和环境科学问题的研究能够定量化并且是在没有干扰(如没有放射性同位素的环境危害)的情况下进行。有些问题还只能通过利用稳定同位素技术来解决。现在,有许多农业研究机构和大学,已经开始使用高精度同位素质谱计从事合理用肥、果实营养、固氮分析、农药毒性、家畜气候对作物的影响以及食品质量控制等多方面的研究工作。与原子能和地质研究工作相比较,在农业和食品方面应用同位素方法从事科研和检测工作,正处于方兴未艾阶段,随着人类社会发展,对农业的要求越来越高,今后大力开展和普及用现代化方法研究农业增产、改善果实质量以及进行食品质量控制检测的工作前途无限广阔。
1、 同位素(Isotope)
由于原子核所含有的中子数不同,具有相同质子数的原子具有不同的质量,这些原子被称为同位素。例如,碳的3个主要同位素分别为12C、13C和14C,它们都有6个质子和6个电子,但中子数则分别为6、7和8。
2、 稳定同位素(Stable isotope)
同位素可分为两大类:放射性同位素(radioactive isotope)和稳定同位素(stable isotope)。
凡能自发地放出粒子并衰变为另一种同位素者为放射性同位素。
无可测放射性的同位素是稳定同位素。 其中一部分是放射性同位素衰变的最终稳定产物。例如206Pb和87Sr等。另一大部分是天然的稳定同位素,即自核合成以来就保持稳定的同位素,例如12C和13C、18O和16O等。与质子相比,含有太多或太少中子均会导致同位素的不稳定性,如14C。这些不稳定的“放射性同位素”将会衰变成稳定同位素。
3、 同位素丰度(Isotope abundance)
① 绝对丰度:指某一同位素在所有各种稳定同位素总量中的相对份额,常以该同位素与1H(取1H=1012)或28Si(28Si=106)的比值表示。这种丰度一般是由太阳光谱和陨石的实测结果给出元素组成,结合各元素的同位素组成计算的。
② 相对丰度:指同一元素各同位素的相对含量。例如12C=98.892%,13C=1.108%。大多数元素由两种或两种以上同位素组成,少数元素为单同位素元素,例如19F=100%。
4、 R值和δ值
①一般定义同位素比值R为某一元素的重同位素原子丰度与轻同位素原子丰度之比. 例如 D/H、13C/12C、34S/32S等,由于轻元素在自然界中轻同位素的相对丰度很高,而重同位素的相对丰度都很低,R值就很低且冗长繁琐不便于比较,故在实际工作中通常采用样品的δ值来表示样品的同位素成分。
②样品(sq)的同位素比值Rsq与一标准物质(st)的同位素比值(Rst)比较,比较结果称为样品的δ值。其定义为:
δ(‰)=(Rsq/Rst -1)×1000
即样品的同位素比值相对于标准物质同位素比值的千分差。
5、 同位素标准(Isotope standard)
δ值的大小显然与所采用的标准有关,所以在作同位素分析时首先要选择合适的标准,不同的样品间的比较也必须采用同一标准才有意义。对同位素标准物质的一般要求是:
(a) 组成均一性质稳定;
(b) 数量较多,以便长期使用;
(c) 化学制备和同位素测量的手续简便;
(d) 大致为天然同位素比值变化范围的中值,便用于绝大多数样品的测定;
(e) 可以做为世界范围的零点。
目前国际通用的同位素标准是由国际原子能委员会(IAEA)和美国国家标准和技术研究所(NIST)颁布的,其主要的分析标准和数据报道如下:
(a) 氢同位素:分析结果均以标准平均大洋水(Standard Mean Ocean Water,即SMOW)为标准报导,这是一个假象的标准,以它作为世界范围比较的基点,其D/H SMOW =(155.76±0.10)×10-6。事实上并不存在SMOW这样一种无知,它是根据NBS-1定义的,NBS-1是由NBS分发的一个水样,它是用Potome河水制成的蒸馏水,相对于SMOW,其氢同位素比值为:δDNBS-1=-47.6‰。后来IAEA分发了两个用作同位素标准的水样V-SMOW和SLAP,其氢同位素比值分别为
δDVSMOW=0‰。
δDSLAP=-428‰。
(b) 碳同位素:标准物质为美国南卡罗来纳州白垩纪皮狄组层位中的拟箭石化石(Peedee Belemnite,即PDB),其13C/12C =(11237.2±90)×10-6,定义其δ13C=0‰。。
(c) 氧同位素:大部分氧同位素分析结果均以SMOW标准报导,它是根据水样NBS-1定义的,18O/16O SMOW=(2005.2±0.43)×10-6, 17O/16O SMOW=(373±15)×10-6;而在碳酸盐样品氧同位素分析中则经常采用PDB标准,其18O/16O=2067.1×10-6,它与SMOW标准之间存在转换关系。相对于SMOW,NBS-1的样同位素比值为:δ18ONBS-1=-7.94‰。两个IAEA标准水样VSMOW和SLAP的氧同位素比值分别为:
δ18OVSMOW=0‰。
δ18OSLAP=-55.50‰。
(d) 硫同位素:标准物质选用Canyon Diablo铁陨石中的陨硫铁(Troilite),简称CDT。34S/32S CDT=0.0450045±93,定义CDT的δ34S=0‰。 。
(e) 氮同位素:选空气中氮气为标准。15N/14N=(3.676.5±8.1)×10-6,定义其δ15N=0‰。 。
(f) 硅同位素:硅同位素组成常以30Si/28Si比值表示,标准是石英砂NBS-28,定义其δ30Si=0‰。
(g) 硼同位素:采用SRM951硼酸做为标准,NBS推荐的11B/10B比值为4.04362±0.00137,定义其δ11B=0‰。
质谱是按照原子(分子)质量的顺序排列的图谱。利用光谱法、核感应法或微波吸收法都可以构成试验装置,进行质谱研究;而历史上把基于电磁学原理设计而成的仪器叫做质谱仪(mass spectrometer或mass spectrograph)。因此种仪器中采用的质量分析器只能对带电粒子起分离作用,所以,要求将被研究的原子(分子)转变成离子,而仪器所获得的信息则是离子的质量m与电荷e之比m/e。近百年来,人们利用质谱仪进行了原子量测定、同位素分离与分析、有机物结构分析和其它科学实验,形成质谱法(mass spetromettry或mass spetroscopy),其在现代分离、分析研究领域中占有重要地位。
质谱仪器的主要特点有:① 擅长同位素分析;② 可以进行多种形态样品(气体、液体、固体、常温、高温、常量、微量……)分析;③ 可以同时(或顺序)检测多种成分;④ 可以连续(或间歇)进样、连续分析;⑤ 可以提供丰富的结构信息;⑥ 可以进行快速分析与实时检测;⑦ 即可进行定性分析,也可定量分析;⑧ 样品用量少,灵敏度很高;⑨ 测量准确度与精密度较高;⑩ 仪器结构复杂,造价较高。同位素比例质谱仪是利用离子光学和电磁原理,按照质荷比(m/e)进行分离从而测定同位素质量和相对含量的科学实验仪器。
1、 IRMS的基本测量过程
在稳定同位素分析中均以气体形式进行质谱分析,因此常有气体质谱仪之称。同位素质谱分析仪的测量过程可归纳为以下步骤:
① 将被分析的样品以气体形式送入离子源;
② 把被分析的元素转变为电荷为e的阳离子,应用纵电场将离子束准直成为一定能量的平行离子束;
③ 利用电、磁分析器将离子束分解为不同m/e比值的组分;
④ 记录并测定离子束每一组分的强度;
⑤ 应用计算机程序将离子束强度转化为同位素丰度;
⑥ 将待测样品与工作标准相比较,得到相对于国际标准的同位素比值。
2、 IRMS的基本原理:
同位素比例质谱仪的原理是首先将样品转化成气体(如CO2,N2,SO2或H2),在离子源中将气体分子离子化(从每个分子中剥离一个电子,导致每个分子带有一个正电荷),接着将离子化气体打入飞行管中。飞行管是弯曲的,磁铁置于其上方,带电分子依质量不同而分离,含有重同位素的分子弯曲程度小于含轻同位素的分子。
在飞行管的末端有一个法拉第收集器,用以测量经过磁体分离之后,具有特定质量的离子束强度。由于它是把样品转化成气体才能测定,所以又叫气体同位素比例质谱仪。以CO2为例,需要有三个法拉第收集器来收集质量分别为44、45和46的离子束。不同质量离子同时收集,从而可以精确测定不同质量离子之间的比率。
带电粒子在磁场中运动时发生偏转,偏转程度与粒子的质荷比m/e成反比。带电离子携带电荷e',通过电场时获得能量e'V,它应与该离子冬动能相等:
1/2m' v' 2=e' V (1)
式中m'和 v'分别为粒子的质量和速度,e'为粒子电荷,V为电压。带电粒子沿垂直磁力线方向进入磁场时,受到洛仑兹力作用,此力垂直于磁场方向和运动方向,力的大小为:
F=e' VB/c (2)
式中B为磁场强度,c为光速。合并(1)和(2)式,得到:
F= (3)
显然,F为粒子质量的函数,确切来说是荷质比 的函数。据此,带电粒子在磁场中运动时因洛仑兹力而偏转,导致不同质量同位素的分离,重同位素偏转半径大,轻同位素偏转半径小。
实际测定中,不是直接测定同位素的绝对含量,因为这一点很难做到;而是测定两种同位素的比值,例如18O/16O或34S/32S等。用作稳定同位素分析的质谱仪是将样品和标准的同位素比值作对比进行测量。
3、 IRMS的基本结构
同位素比例质谱仪与其它质谱仪一样,其结构主要可分为进样系统、离子源、质量分析器和检测器四部分,此外还有电气系统和真空系统支持。
(a) 进样系统:即把待测气体导入质谱仪的系统。它要求导入样品但不破坏离子源和分析室的真空。为避免扩散引起的同位素分馏,要求在进样系统中形成粘滞性气体流,即气体的分子平均自由路径小于储样器和气流管道的直径,因此气体分之间能够彼此频繁碰撞,分子间相互作用,形成一个整体。。
(b) 离子源:在离子源中,待测样品的气体分子发生电离,加速并聚焦成束。针对某种元素,往往可以采用不止一种离子源测定同位素丰度。对离子源的要求是电离效率高,单色性好。
(c) 质量分析器:接收来自质量分析器的具有不同荷质比的离子分开。主体为一扇形磁铁。要求其分离大,聚焦效果好。
(d) 离子检测器:接收来自质量分析器的具有不同荷质比俄离子束,并加以放大和记录。由离子接收器和放大测量装置组成。离子通过磁场后,待分析离子束通过特别的狭缝后,重新聚焦落到接收器上并收集起来。接收器一般为法拉第筒。现代质谱仪都有两个或多个接收器以便同时接收不同质量数的离子束,交替车辆样品和标准的同位素比值并将两者加以比较,可以得到高的测量精度。对检测部分的要求是灵敏度高,信号不畸变。
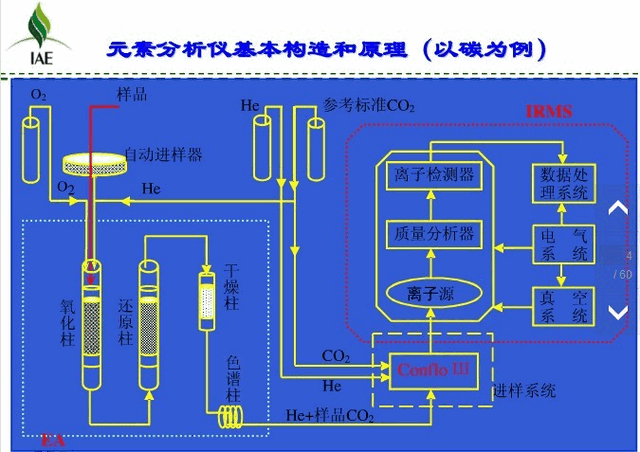
4、 IRMS的主要部件
Finnigan MAT DeltaplusXP同位素比例质谱仪是一种用于精密测定13C、15N、18O和34S同位素比值的中型质谱仪。该IRMS系统部件主要由系统主机、四个外设、两个接口和一个工作站组成。
① 主机即质谱仪,由离子源、质量分析器、检测器、电气系统以及真空系统组成。
② 四个外设包括:燃烧型元素分析仪(flash EA1112)、高温裂接元素分析仪(TC/EA)、气相色谱仪(GC)和预浓缩装置(PreCon)。
③ 两个接口:连接元素分析仪的连续流接口(即Conflo Ⅲ)和连接气相色谱仪的带燃烧、裂接的接口(GCC)。
④ 一个工作站:一台运行控制程序ISODAT NT的奔腾计算机。
随着同位素质谱测试技术的改进,大大拓宽了稳定同位素的研究领域。除了人们所熟知的“稳定同位素地球化学”已形成一门独立的学科外,稳定同位素技术还应用于农业、医学和环境科学研究领域。通过同位素分析,可以得知农作物施肥的最佳配方比和时间;诊疗病症;了解物品组成成分与来源;推断古气候及环境条件特征 总结它的应用主要分为两个方面: ①各种物质同位素δ值存在着天然的差异。 ②稳定同位素示踪方法 同位素质谱测试技术应用的几个实例:
1、 同位素比例质谱法鉴别海洛因来源
当前,毒品来源推断技术已成为国际上的研究热点之一。化合物的稳定同位素比值被称为该化合物的“同位素签字”,它能反映化合物的来源信息。海洛因是由吗啡经二乙酰化得到,海洛因的13C同位素比值能反映海洛因的合成和来源信息,但由于乙酰基对13C的贡献,不能完全反映吗啡来源地信息。因此,为研究海洛因的来源地,应排除乙酰基的影响,即把海洛因水解为吗啡,再测定吗啡的13C同位素比值来推断其原产地。
2、 生态系统中污染物的监测与环境保护
在不同环境条件下,稳定同位素的组成会有一定的差异。譬如不同来源的含氮物质可以具有不同的氮同位素组成,因此氮同位素是一种很好的污染物指示剂。目前,化肥的使用非常普遍,土壤中的氮肥及其它的含氮有机物随着水土的流失而流进江河湖海,因此δ15N值可以作为水域环境污染程度指标。
3、 食品质量控制方面的应用
根据植物C3和C4循环产物的δ13C值得不同,碳同位素技术在食品质量控制方面可以发挥特别的作用,能够解决常规分析技术解决不了的问题。例如,常规归分析技术无法分别甜菜糖和蔗糖,但甜菜是C3植物,δ13C约为-25.5‰,蔗糖是C4植物,δ13C约为-11.5‰,应用碳同位素技术则可以轻而易举地加以区分。同样枫树是C3植物,δ13C=-22.4‰~-25.5‰,所以在枫树糖浆中若掺入蔗糖,用δ13C分析即可检出。同样的方法可以鉴别蜂蜜(主要来自C3植物)中掺入的蔗糖,或是区别天然香料(δ13C约为-20‰)和合成香料(δ13C=-27‰)等。谷物发酵形成酒精的过程中碳同位素分馏不超过千分之几,所以也可用来鉴别酒类。应用碳同位素技术甚至可以坚定喂蛋鸡的饲料,用麦子喂养鸡的蛋其δ13C=-23.7‰,玉米喂养鸡的蛋其δ13C=-11.0‰,混合饲料喂养鸡时的蛋其δ13C介于其间。
同样的原理还可以应用于考古,由于有机残余物的δ13C可追溯古代文明的食品状况。把碳和氧同位素综合应用,还可对于不同食品的混合作出更精细的判断。
----------转载自祁彪科学网博客